Благовещенский собор Московского Кремля
Один из древнейших храмов Московского Кремля стоит на краю Соборной площади на бровке Боровицкого холма. Много веков...
Задачи урока:
Образовательная: познакомить учащихся с природными соединениями железа, рассмотреть важнейшие соединения железа (+2) и (+3), их свойства, ознакомить с качественными реакциями на ионы железа (+2) и (+3), показать народнохозяйственное значение соединений железа;
Развивающая: развитие речи, памяти, логического мышления, умений совместной деятельности; развитие и закрепление умений и навыков работать с лабораторным оборудованием;
Воспитательная: формирование мировоззрения, навыков сотрудничества, преемственности знаний, осуществление межпредметных связей, воспитание экологической грамотности, разумного отношения к природе (слайд 2).
Оборудование и реактивы:
образцы природных соединений железа (магнитный железняк, красный железняк, бурый железняк, железный колчедан); растворы хлорида железа (II) и (III), растворы красной кровяной соли и жёлтой кровяной соли, раствор роданида калия, раствор щёлочи; соли: железный купорос, хлорид железа (III), сульфат железа (III), необходимая химическая посуда.
Тип урока: комбинированный.
Ход урока
I. Организационный момент.
II. Актуализация знаний.
1 вариант
1) Fe + H 2 SO 4р-р =
3) Fe + AgNO 3 =
2 вариант
Закончите уравнения реакций. Уравнение №2 рассмотрите с точки зрения ОВР.
3 вариант
Закончите уравнения реакций. Уравнение №2 рассмотрите с точки зрения ОВР.
3) Fe + Cu(NO 3) 2 =
III. Изучение нового материала.
Нахождение железа в природе
Железо (5%) – второй по распространённости металл в земной коре, а в природе занимает 4 место. В природе встречается в виде оксидов и сульфидов:
Fe 3 O 4 – магнитный железняк (магнетит);
Fe 2 O 3 – красный железняк (гематит);
(Врач и алхимик Теофаст Парацельс много путешествовал и в 1530г из России привёз в свою лабораторию в г. Базеле кусок вишнёво – красного минерала – “кровавика”. Минерал действительно оставлял “кровавый” след – красную черту на пергаменте или белом камне. Помощник Парацельса, невежественный монах, решил, что минерал из России – застывшая кровь дьявола. Готовя составные части лекарств прокаливанием солей, полученных из “русского минерала”, монах всякий раз получал порошок красного цвета. Сиреневые кристаллы сульфата и нитрата железа (III), жёлтый хлорид железа (III) или почти белый карбонат железа (II) – все они при нагревании в токе воздуха превращались в “кровавик”. Бросив работу, монах стал повсюду рассказывать, что Парацельс связан с дьяволом. В адрес знаменитого врача посыпались угрозы, и ночью ему пришлось тайно покинуть Базель. Утром толпа горожан разгромила и сожгла его дом).
“Кровавик” - это минерал гематит Fe 2 O 3 . Соли железа при прокаливании разлагаются с выделением этого оксида красного цвета.)
2Fe 2 O 3 *3H 2 O – бурый железняк (лимонит);
FeS 2 – железный колчедан (пирит).
Помимо железа в состав этих минералов входят другие элементы. Природное химически чистое железо бывает только метеоритного происхождения (самый большой метеорит найден в 1920 г. в Юго – Западной Африке, вес 60 т., “Гоба”) (демонстрация коллекции минералов) (Cлайд 3).
Железо образует несколько рядов соединений, чтобы узнать какие мы должны с вами вспомнить, какова особенность строения атома железа и какие степени окисления характерны для железа?
Fe +26 2е, 8е, 14е, 2е
(Fe – элемент 7 группы побочной подгруппы, 4 периода (большой). Заполняется не последний, а предпоследний, 3-й от ядра энергетический уровень, где максимальное число электронов 18, у железа здесь 14 электронов. Железо восстановитель, как и другие металлы, однако в отличие от ранее изученных металлов, атомы железа при окислении отдают не только электроны последнего уровня, приобретая степень окисления +2, но способны к отдаче 1 электрона с предпоследнего энергетического уровня, принимая при этом степень окисления +3. Для железа характерны две основные степени окисления +2 и +3).
Проявляя степени окисления +2 и +3 железо образует 2 ряда соединений.
Соединения железа (+2).
Соединения железа (+2): FeO (оксид железа(II) и Fe(OH) 2 (гидроксид железа(II). Имеют ярко выраженный основный характер. Получают их косвенно. Рассмотрим генетический ряд Fe +2:
Соединения железа (+3).
Соединения железа (+3): Fe 2 О 3 (оксид железа(III)) и Fe(OH) 3 (гидроксид железа(III)). Имеют слабо выраженные амфотерные свойства. Получают их косвенно. Рассмотрим генетический ряд Fe +3:

Катионы железа (+2) легко окисляются кислородом воздуха или другими окислителями до катионов железа (+3). Поэтому белый осадок Fe(OH) 2 (гидроксид железа(II) на воздухе сначала приобретает зелёную окраску, а затем становится бурым, превращаясь в Fe(OH) 3 (гидроксид железа(III) (демонстрационный опыт
)
Соли железа (+2) и (+3).
Железо образует 2 ряда солей Fe +2 и Fe +3 . Для распознавания соединений железа (+2) и (+3) проводят качественные реакции на данные ионы (качественные реакции – это реакции с помощью которых распознают различные вещества, они сопровождаются ярким внешним эффектом).
Качественные реакции на Fe +2 .
Реактивом служит красная кровяная соль.

Качественные реакции на Fe +3.
Реактивом служит жёлтая кровяная соль.
Также для обнаружения ионов железа(III) используют взаимодействие солей железа(III) с роданидом калия или аммония, в результате чего раствор приобретает интенсивно-красное окрашивание.

Техника безопасности: необходимо брать вещества в количествах указанных учителем; при попадании данных химических реактивов на кожу или одежду необходимо смыть реактивы избытком воды; если что-нибудь попало в глаза – промыть водой в течение 10-15 минут.
(просмотр диска; демонстрация образцов солей; опыты учащихся) (Cлайд 4, 5).
Применение соединений железа
Железо выполняет функции кроветворных органов, входит в состав гемоглобина, других сложных белковых животных организмов. В виде чугуна и стали железо находит широкое применение в народном хозяйстве. Из солей железа наибольшее техническое значение имеют сульфаты и хлориды.
FeSO 4 *7H 2 O – железный купорос используется для борьбы с вредителями растений, для приготовления минеральных красок и т.д.;
FeCl 3 – используется как протрава при крашении тканей и в качестве катализатора в органическом синтезе;
Fe 2 (SO 4) 3 *9H 2 O – применяют для очистки воды, в виде квасцов в медицине.
(просмотр диска; демонстрация образцов солей)
На уроке мы с вами рассмотрели соединения железа (+2) и (+3). Познакомились с нахождением железа в природе: минералы магнетит, гематит, лимонит, пирит. Изучили соединения железа (+2) (FeO (оксид железа(II) и Fe(OH) 2 (гидроксид железа(II) и их свойства; соединения железа (+3) (Fe 2 О 3 (оксид железа(III) и Fe(OH) 3 (гидроксид железа(III), их свойства. Рассмотрели лёгкость окисления Fe +2 в Fe +3 кислородом воздуха. Узнали, что железо образует 2 ряда соединений:
Fe +2: реактивом служит красная кровяная соль, образуется тёмно-синий осадок (турнбулева синь);
Fe +3: реактивом служит
1) жёлтая кровяная соль, образуется тёмно-синее окрашивание (берлинская лазурь);
2) роданид калия или аммония, образуется интенсивно-красное окрашивание.
Рассмотрели применение соединений железа: в металлургии, медицине, при очистке воды, при окраске тканей, для борьбы с вредителями и в других отраслях народного хозяйства.
V. Закрепление.
Задача. Какая масса железа может быть получена при действии на 96 г оксида железа(III) избытка оксида углерода(II), если выход реакции составляет 80% от теоретически возможного? (Cлайд 6)

VI. Рефлексия.
Закончите предложения или дайте ответ на поставленный вопрос.
Мне больше всего понравилось…
Сегодня я узнал…
Было сложно…
Было интересно…
Теперь я могу…
Я попробовал…
Домашнее задание: учебник Габриелян О. С. п.14 (стр. 65-67); упр. 5,6 письменно (Cлайд 7).
Полнотекстовый поиск:
Уникальная информативность мессбауэровской спектроскопии, относительная простота эксперимента и разработанные теоретические основы обусловили широкое применение мессбауэровской спектроскопии в физике и химии твердого тела, ядерной физике, геологии и археологии, аналитической химии, химической технологии.
1.3 Комплексные соединения железа в растворе
Железо, будучи переходным элементом, является типичным комплексообразователем. Железо образует устойчивые КС, находясь в валентном состоянии Fe (III) и Fe (II). Комплексообразование стабилизирует соединения малоустойчивой для железа степени окисления +2.
Железо образует достаточно большое количество комплексных соединений. Наиболее характерным для железа (II) и железа (III) является координационное число (КЧ) = 6 (реже 4 и 5). Способность к комплексообразованию более характерна для железа в С/О = +3. Рассмотрим некоторые комплексы железа и методы их получения.
Для железа (II) очень устойчивы цианидные комплексы
(цианоферраты (II)). Наиболее известным из них является гексацианоферрат (II) калия - желтая кровяная соль.Желтая кровяная соль (гексацианоферрат (II) калия - K
4 ) известна с середины XVIII века. Первоначально ее получали сплавлением отходов скотобоен (например, крови животных, копыт, кож и т. п.) с поташем (К 2 СO 3 ) и железными обрезками. После остывания расплава и выщелачивания его водой получали желтую кровяную соль.Сейчас гексацианоферрат (II) калия получают, действуя избытком KCN на соли двухвалентного железа:
FeCl 2 + 6KCN = K 4 + 2KC1.
При добавлении к раствору солей трехвалентного железа раствора желтой кровяной соли образуется темно-синий осадок, называемый
берлинской или npyccкой лазурью :4FeCl 3 + 3K 4 = Fe III 4 3 + 12KCl.
Фото. 2. Берлинская лазурь
3+ .
Если на желтую кровяную соль подействовать окислителем (хлором, перманганатом калия), то получается комплексная соль трехвалентного железа гексацианоферрат (III) калия - K 3 , которая окрашена в красный цвет и называется красной кровяной солью.
2K 4 + С1 2 = 2K 3 + 2KC1.

Фото. 1. Красная кровяная соль.
Красная кровяная соль (комплекс 3- ), менее устойчива, чем желтая (комплекс 4- ), и поэтому очень ядовита.

Рис. 5. Энергетическая диаграмма 4- (метод МО).
При взаимодействии растворов солей двухвалентного железа с красной кровяной солью образуется темно-синий осадок, называемый турнбулевой синью:
3FeCl 2 + 4K 3 = Fe III 4 3 + 6KC1 + 6KCN.
Это - качественная реакция на соли Fe 2+ .
Ранее считалось, что при этом образуется гексацианоферрат (III) железа (II), то есть Fe II 3 2 , именно такую формулу предлагали для «турнбулевой сини». Теперь благодаря исследованиям по методу мессбауэровской спектроскопии известно, что турнбулева синь и берлинская лазурь - одно и то же вещество, а в процессе реакции происходит переход электронов от ионов Fe 2+ к гексацианоферрат (III)- иону :
Fe 2+ + 3- → Fe 3+ + 4- .
Этот процесс происходит практически мгновенно, а обратную реакцию можно осуществить лишь в вакууме при 300 0 С . Этот факт объясняется, по-видимому, тем, что комплекс 4- более устойчив, чем 3- .
Турнбулева синь и берлинская лазурь плохо растворимы в воде, что затрудняет их использование в виде красок. Для повышения растворимости гексацианоферратов вводят ионы калия вплоть до состава KFe (последнее соединение называется растворимой берлинской лазурью). По мере увеличения содержания ионов калия цвет соединений меняется от темно- до светло-синего.
Схема структуры растворимой «берлинской лазури» – «турнбулевой сини» (кристаллогидрат вида KFe III ·H 2 O) приведена на рисунке 6 .

Рис. 6. Кристаллическая решетка «берлинской лазури»
Из неё видно, что атомы Fe 2+ и Fe 3+ располагаются в кристаллической решётке однотипно, однако по отношению к цианидным группам они неравноценны, преобладает тенденция к размещению Fe 2+ между атомами углерода, Fe 3+ - между атомами азота, ионы К + и молекулы H 2 O располагаются в пустотах кристаллической решетки.
Хотя состав, структура и кристаллические решетки берлинской лазури и турнбулевой сини идентичны, различные исторические названия продолжают сохраняться, отражая химию ионов железа в различных степенях окисления.
Это комплексное соединения образуется при взаимодействии железа 3+ с тиосульфатом натрия. Комплексное соединение окрашено в интенсивный фиолетовый цвет .
FeCl 3 + 2 Na 2 S 2 O 3 → 3 NaCl + Na
2Na →FeS 2 O 3 + FeS 4 O 6 +Na 2 S 2 O 3
В кислой среде фосфаты и фосфорная кислота с ионами железа образуют бесцветные комплексы 3- :
FeCl 3 + H 3 PO 4 + K 3 PO 4 → K 3 + 3HCl
Катион 2+ малоустойчив и водой мгновенно разлагается :
2+ + 6H 2 O = Fe(OH) 2 ↓ + 4NH 3 ∙H 2 O + 2NH 4 +
К числу высокоспиновых комплексов Fe 2+ , образованных монодентантными лигандами, относятся акваионы 2+ , КС с галогенид-ионами, например, K 2 , в структуре которого зафиксированы конденсированные октаэдры .
Железо (II) в КС с полидентантными лигандами неустойчиво, так как быстро окисляется кислородом воздуха и водой, переходя в более термодинамически стабильные КС железа (III) .
Триоксалатоферрат (III) калия получают при взаимодействии сульфата железа (III), оксалата бария, и оксалата калия в водном растворе:
Fe 2 (SO 4 ) 3 + Ba 2 (C 2 O 4 ) 2 + 4K 2 C 2 O 4 = 2K 3 + 2BaSO 4 + K 2 SO 4
Под действием света с длиной волны меньше 490 нм Fe(III) количественно восстанавливается до Fe(II) за счет окисления части ионов C 2 O 4 2- до CO 2 :
2K 3 = 2K 2 + K 2 C 2 O 4 + 2CO 2
Образующийся при этом оксалатный комплекс железа (II) хорошо растворим в воде, и выделяется из раствора в виде кристаллогидрата K 2 ∙6H 2 O золотисто-желтого цвета.

Фото. 3. Триоксалатоферрат (II) калия
Термин хелат (англ. chelate от греческого «клешня») принят для обозначения циклических структур, которые образуются в результате присоединения катиона к двум или более донорным атомам, принадлежащим одной молекуле комплексона. В соответствии с термином хелат эти соединения следует представлять в виде какого-то краба, который своими полидентатными клешнями прочно захватывает ион металла, и чем больше клешней, тем прочнее захват. Как буквальный перевод слова chelate в литературе до сравнительно недавнего времени для обозначения комплексных соединений с циклическими структурами использовался термин "клешневидные соединения" .
Замыкание циклов при образовании хелатных соединений является важным фактором, обусловливающим высокую устойчивость комплексонатов. Комплексные соединения, содержащие циклические группировки, отличаются более высокой прочностью, чем соединения, не содержащие циклов, а наибольшей устойчивостью обладают комплексы с пяти- и шестичленными циклами.
Хелатные комплексы наиболее характерны для комплексонов. Термин «комплексоны» предложен в 1945 году профессором Цюрихского университета Г. Шварценбахом (1904 - 1978) для органических лигандов группы полиаминополикарбоновых кислот .
Наиболее часто используемым комплексоном является этилендиаминтетраацетат (ЭДТА, трилон-Б).

Комплекс железа с ЭДТА ( - ) относится к числу низкоспиновых. В нем лиганд ЭДТА 4- , как обычно, гексадентантен. Однако, КЧ иона Fe 3+ равно 7, поскольку, кроме четырех атомов кислорода и двух атомов азота, ЭДТА 4- во внутреннюю сферу КС входит атом кислорода внутрисферной гидратной воды:
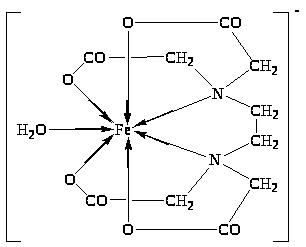
Образование хелатных структур характерно не только для комплексонов, но для других органических соединений. Например, очень устойчивы КС железа с бета-дикетонами. Простейший из бета-дикетонов железа – трисацетилацетонат Fe(AcAc) 3 .

При нагревании сублимируется без разложения. В его молекуле имеются 3 шестичленных хелатных цикла. Несмотря на принадлежность к высокоспиновым соединениям, трисацетилацетонат железа (III) ведет себя как соединение с молекулярной структурой: ионная составляющая связи Fe III – лиганд экранируется углеводородными радикалами лиганда, в результате чего для соединения характерно слабое «органоподобное» межмолекулярное взаимодействие. Это объясняет его способность растворяться в малополярных растворителях и легко сублимироваться (150 0 С).
В качестве неофициальных реакций наиболее чувствительным реактивом на железо (II) является спиртовой раствор диметилглиоксима, который образует с железа (II) ионом комплексное хелатное соединение красного цвета, нерастворимое в растворе аммиака :
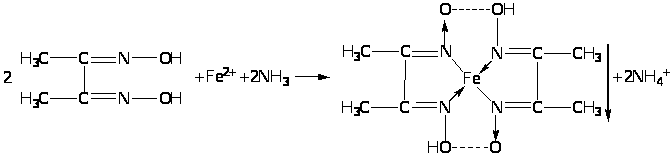
1.3.7. Нитропруссид натрия.
Производное гексацианоферрата (III) железа, называемое нитропруссидом натрия Na 2 ∙2H 2 O (кристаллы темно-красного цвета), можно получить, например, по реакции :
Na 3 + NO = Na 2 + NaCN
Таблица 3. Характеристика комплексных соединений железа.
|
Название |
Валентность железа |
Спиновое состояние |
Схема расщепления d-орбиталей |
|||
|
Тетрафтороферрат (II) |
|
|||||
|
Нитропруссид |
|
|||||
|
Гексаакважелезо (II) |
|
|||||
|
Комплекс с диметилглиоксимом (ДМГ) |
||||||
|
Гексаамминжелезо (II) |
||||||
|
гексацианоферрат(II) |
||||||
|
гексацианоферрат(III) |
|
|||||
|
Дитиосульфатоферрат (III) |
|
|||||
|
Дифосфатоферрат (III) |
||||||
|
Триоксалатоферрат (III) |
|
|||||
|
Комплекс с ЭДТА |
|
Вначале необходимо приготовить оксалат бария, для чего к раствору 1,5 г оксалата натрия в 40 мл воды прилить раствор 2,5 г дигидрата хлорида бария в 6 мл воды. Выпавшие кристаллы отфильтровать на воронке Бюхнера и промыть несколько раз холодной водой .
Для получения триоксалатоферрата (III) калия в стакан емкостью 50-100 мл поместить 1,25 г сульфата железа (III), полученный оксалат бария, 1,5 г оксалата калия и 30 мл воды. Нагревать смесь в течение нескольких часов на водяной бане, поддерживая постоянный объем. После отделения осадка сульфата бария упарить фильтрат до объема 5 мл и охладить. Кристаллы триоксалатоферрата (III) калия отфильтровать, промыть небольшим количеством воды, а затем спиртом и высушить в вакуум-эксикаторе над серной кислотой. Препарат следует защищать от солнечного света, сушку лучше производить в темном месте.
Приготовить раствор 4 г FeCl 3 в 3,5 мл воды и раствор 9,3 г ЭДТА в 30 мл воды. Нагревать смесь в течение нескольких часов на плитке, затем дать остыть. Выпавшие кристаллы отфильтровать и высушить.
При выращивании кристаллов необходимо учитывать, что если кристаллизация идет очень медленно, получается один большой кристалл если быстро - множество мелких кристаллов. Вещества, состоящие из одного кристалла, - монокристаллы.
Выращивают кристаллы разными способами: например, охлаждая насыщенный раствор. С понижением температуры растворимость большинства веществ уменьшается, и они, как говорят, выпадают в осадок. Сначала в растворе и на стенках сосуда появляются крошечные кристаллы-зародыши, а затем идет кристаллизация по всему объему раствора. Когда охлаждение медленное, а в растворе нет твердых примесей (скажем, пыли), зародышей образуется немного, и постепенно они превращаются в красивые кристаллы правильной формы .
Приготовить горячие насыщенные растворы FeCl 3 и желтой кровяной соли. Растворы смешать в химическом стакане, выпавший осадок отфильтровать на воронке Бюхнера и поместить в чистую фильтровальную бумагу для получения затравки. Через неделю выбрать самый большой кристалл для затравки, обвязать его лавсановой нитью и поместить в маточный раствор. Через 14 дней были получены более крупные кристаллы.
Приготовить горячие насыщенные растворы FeSO 4 и красной кровяной соли. Растворы смешать в химическом стакане, выпавший осадок отфильтровать на воронке Бюхнера и поместить в чистую фильтровальную бумагу для получения затравки. Через неделю выбрать самый большой кристалл для затравки, обвязать его лавсановой нитью и помещают в маточный раствор. Через 14 дней получают более крупный кристалл, в форме куба.
1) выращенные кристаллы имеют кубическую форму, что соответствует литературным данным. При рассматривании через микроскоп подтверждается кубическая структура кристалла.
2) окраска кубических кристаллов "турнбулевой сини"-"берлинской лазури" очень близка, что указывает на идентичность их структуры.
3) поскольку более устойчивым является цианидный комплекс Fe (II), то при образовании "турнбулевой сини" происходит валентный переход:
3- + Fe 2+ = Fe 3+ + 4-
4) таким образом, осуществляется переход к более устойчивому цианидному комплексу Fe (II), т. е. к "берлинской лазури".
5) окраска полученного комплексного соединения железа (III) с ЭДТА соответствует литературным данным (желтая).
6) окраска полученного триоксалатоферрата (III) калия соответствует литературным данным (оранжево-коричневая).
1) целью данной работы было установить кубическую структуру и идентичность "турнбулевой сини"-"берлинской лазури".
2) выращены кристаллы турнбулевой сини и берлинской лазури.
3) визуальный осмотр полученных кубических кристаллов свидетельствует о близости формы и окраски этих кристаллов, в том числе и при осмотре через микроскоп.
4) сделан вывод на основании литературных данных, что за счет валентного перехода Fe II 3 2 превращается в Fe 4 3 , т. е. процесс идет в направлении создания более устойчивого комплекса Fe (II).
5) получено 2,32 грамма триоксалатоферрата Fe(III), что составляет 85% от теоретического выхода
6) получен комплекс железа (III) с ЭДТА
Теория кристаллического поля.
http://www.college.ru/chemistry/course/content/theory.html - WWW, курс «Открытая Химия 2.5», 2007
Налбандян В. Б. Курс лекций по общей и неорганической химии. – WWW.: Химический факультет РГУ, 2002.
Гольданский В.И. Эффект Мёссбауэра. М.: Изд-во АН СССР, 1963;
Мёссбауэр Р.Л. Резонансное ядерное поглощение квантов в твердых телах без отдачи. Успехи физических наук, 1960, т. 72, вып. 4, с. 658–671.
И.В. Овчинников, Ю.Г. Галяметдинов. Магнитные жидкие кристаллы на основе координационных соединений. // Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И. Менделеева). – 2001. – т. XLV, №3. – С. 74-79.
Леенсон И. Лазурь берлинская.
http://www.krugosvet.ru/articles/111/1011153/1011153a1.htm - WWW, энциклопедия «Кругосвет», 2007.
Практикум по неорганической химии: Учеб. пособие /под ред. В.П. Зломанова. – М.: Изд-во МГУ, 1994 – 320с.
Мелентьева Г.А. Фармацевтическая химия: В 2 т. – М.: “Высшая школа”, 1976. – Т.1 – 780 с.; Т. 2. – 827 с.
Беликов В.Г. Фармацевтическая химия: Учеб. для фармац. ин-тов и фак. мед. ин-тов. – М.: “Высшая школа”, 1985. – 768 с.
Максютина Н.П и др. Методы анализа лекарств, - Киев: Здоровье,1987
Пономарев В.Д. Аналитическая химия. – М.: Химия,1982
Крамаренко В.Ф. Токсикологическая химия. – Киев: Выща школа, 1989 г. - 447 с.
Справочник школьника по химии 8-11 класс. / под ред. Н.Е. Кузьменко, В.В. Еремина - М.: ООО «Издательский дом «ОНИКС 31 век»:ООО «Издательство «Мир и Образование», 2003. - 624 с.
Третьяков Ю.Д. Неорганическая химия. Химия элементов: учебник для вузов. В 2 книгах. - М.: Химия, 2001 - 472с.
Химическая энциклопедия. В 5 томах. Том 1. / под ред. Кнунянца И.Л., Зефирова Н.С., Кулова Н.Н. – М.: Большая российская энциклопедия, 1988 – 624 с.
В.П. Васильев. Комплексоны и комплексонаты. // Соросовский образовательный журнал. – 1996. – № 4. – с. 39-44.
Энциклопедия для детей. Том 17. Химия. / глав. ред. В. А. Володин. – М.: Аванта+, 2000. – 640 с.
Турова Н.Я., Неорганическая химия в таблицах. – М.: Высш. хим. колл. РАН, 1999. – 140 с.
Параметры мёссбауэровских спектров:
1) Вероятность эффекта Мёссбауэра в общем случае записывается в виде :

где <
x
2
>-
средний квадрат смещения ядер в
поглотителе из положения равновесия
при твердотельных колебаниях в направлении
пучка γ-квантов,
l
-длина
волны γ-кванта. Величина
<х
2
>
зависит от фононного спектра твердого
тела и его абсолютной температур Т. С
ростом температуры
Исследования зависимостей f" от температуры используют при установлении координационных чисел, для определения фазовых переходов и изучения характерных динамических параметров твердых тел до и после фазового перехода. Особенно эффективен этот метод в области низких и сверхнизких температур и для некристаллических веществ, когда, как правило, затруднены рентгеноструктурные исследования.
Площади спектральных линий, наблюдаемые экспериментально, пропорциональны концентрации исследуемого атома в образце при фиксированной температуре. На измерении этих площадей основано применение мессбауэровской спектрометрии для решения некоторых задач аналитической химии и фазового анализа вещества .
2)Энергетический сдвиг спектра излучения относительно спектра поглощения вычисляется как сумма температурного сдвига dT и изомерного сдвига d .
Температурный (доплеровский) сдвиг линии возникает вследствие изменения энергии γ-квантов при их излучении и поглощении в результате релятивистского изменения массы излучающих и поглощающих ядер соответственно ("красное смещение"). Например, для 57 Fe ожидаемое смещение при переходе от комнатной температуры к Т → 0 близко к естественной ширине линии. Поскольку различие в температурах источника и поглотителя более 300 К встречается редко, вклад dT мал и обычно маскируется более сильным сдвигом, который от температуры не зависит.
Для тождественных ядер в отсутствии электрических и магнитных полей спектр представляет собой одиночную линию (рис. 7, а).
Изомерный (химический) сдвиг связан с электрическим монопольным кулоновским взаимодействием между ядром с зарядовым радиусом r и электронами атома :
![]()
где
е
-элементарный
заряд,
Z
-атомный
номер, ∆
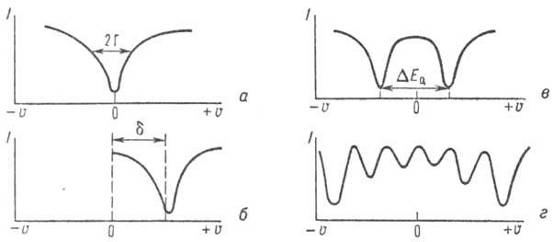
Рис. 7. Схематическое изображение спектров мёссбауэровского резонансного поглощения γ-квантов: I-интенсивность потока γ-квантов, прошедших через поглотитель, u -скорость движения источника γ-квантов относительно поглотителя; а - резонансная линия при u = 0; б, в, г - соответственно изомерный сдвиг (d), квадрупольный дублет (DE Q), магнитная сверхтонкая структура для ядер 57 Fe.
Значения δ отсчитывают от стандарта, который принят для спектроскопии данного ядра. При этом выбирают соединения, стабильное химически и дающее простой мёссбауэровский спектр. Например, в случае 119 Sn δ отсчитывается от значения, соответствующего соединению 119 SnO 2 , а для 57 Fe в качестве стандарта используют нитропруссид натрия.
По величине химического сдвига можно судить о различии в характере химических связей. С помощью мессбауэровской спектроскопии изучено большое число соединений, составлены номограммы, с помощью которые по δ определяют валентность элемента в неизученных соединениях. В зависимости от конфигурации валентных электронных оболочек атомов и ионов могут быть проведены квантовомеханические расчеты для свободных атомов. Однако для атомов в твердых телах эти расчеты носят пока полуколичественный характер.
3) Электрическое квадрупольное взаимодействие возникает вследствие взаимодействия квадрупольного момента ядра Q с градиентом электрического поля q, создаваемого электронной оболочкой атома или кристаллической решеткой твердого тела, в результате чего в спектрах поглощения наблюдается не одна, а несколько линий. Если спин ядра Конспект >> Маркетинг
... (соединений марганца, железа , меди), способностью... при понижении температуры - римскими цифрами (I, II , III и т. д.). Характерные признаки кристаллического состояния... весь комплекс механических свойств материала... включают анализ и синтез , индукцию и дедукцию...
Превращается в ангиотензин II , который увеличивает... бугра, амигдалоидного комплекса , миндалин, экстрапирамидной... на синтез тироксина в щитовидной железе ). ... преодолевает снотворные свойства мелатонина. ... течение 4-х суток. III группа - ежедневное однократное...
Со специальными свойствами (ретикулярная, ... сетью и комплексом Гольджи. ... ЖЕЛЕЗЫ ЭНДОКРИННАЯ ЧАСТЬ ПОЛОВЫХ ЖЕЛЕЗ и ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Щитовидная железа ... II -III - IV-V пальцам. Каждая из I, II , III ... нейросекреторных клетках протеино-синтез преобладает, а...
Выраженные основные свойства . Катионы железа (II ) Fe2+ ... целях. Для распознавания соединений железа (II ) и (III ) проводят качественные реакции... синтеза железопорфириновых белков гемоглобина и других составляющих крови. В крови оно переносится в форме комплекса ...
Позиция Ребенка (III ). В двух... условных рефлексов. II .Стадия перцептивной психики... волевых и эмоциональных свойств ), характер (синтез отношений и... совокупности различных свойств и частей. Комплекс действующих... инволюция зобной железы и лимфатического...
Т. д. III вариант. ... двух (I и II ) подразделений хозяйства... угля - 30, железа - 32, никеля... потребительский комплекс . Потребительский комплекс национальной... и сверхвысококачественный синтез энергоносителей; ... заранее заданными свойствами . Применяются наукоемкие...
Соединения железа (III)
Соединения железа (II)
Соединения железа со степень окисления железа +2 малоустойчивы и легко окисляются до производных железа (III).
Оксид железа (II) – порошок черного цвета͵ в мелкораздробленном состоянии воспламеняется. Кристаллизуется в структурном типе хлорида натрия (кубическая гранецентрированная решетка).
Проявляет преимущественно основные свойства. В воде не растворяется, легко растворяется в неокисляющих кислотах:
FeO + 2HCl = FeCl 2 + H 2 O.
Проявляет восстановительные свойства:
3FeO + 10HNO 3 = 3Fe(NO 3) 3 + NO + 5H 2 O.
Получается разложением оксалата железа (II) в атмосфере азота или без доступа воздуха:
FeC 2 O 4 ·3H 2 O = FeO + 3H 2 O + CO 2 + CO
или в процессе восстановления оксида железа (III) водородом или оксидом углерода (II):
Fe 2 O 3 + CO = 2FeO + CO 2 .
Гидроксид железа (II) Fe(OH) 2 в свежеосажденном виде имеет серовато-зеленую окраску, в воде не растворяется, при температуре выше 150 °С разлагается, быстро темнеет вследствие окисления:
4Fe(OH) 2 + O 2 + 2H 2 O = 4Fe(OH) 3 .
Проявляет слабовыраженные амфотерные свойства с преобладанием базовых, легко реагирует с неокисляющими кислотами:
Fe(OH) 2 + 2HCl = FeCl 2 + 2H 2 O.
Взаимодействует с концентрированными растворами щелочей при нагревании с образованием тетрагидроксоферрата (II):
Fe(OH) 2 + 2NaOH = Na 2 .
Проявляет восстановительные свойства, при взаимодействии с азотной или концентрированной серной кислотой образуются соли железа (III):
2Fe(OH) 2 + 4H 2 SO 4 = Fe 2 (SO 4) 3 + SO 2 + 6H 2 O.
Получается при взаимодействии солей железа (II) с раствором щелочи в отсутствии кислорода воздуха:
FeSO 4 + 2NaOH = Fe(OH) 2 + Na 2 SO 4 .
Соли железа (II).
Железо (II) образует соли практически со всеми анионами. Обычно соли кристаллизуются в виде зеленых кристаллогидратов: Fe(NO 3) 2 ·6H 2 O, FeSO 4 ·7H 2 O, FeBr 2 ·6H 2 O, (NH 4) 2 Fe(SO 4) 2 ·6H 2 O (соль Мора) и др.
Размещено на реф.рф
Растворы солей имеют бледно-зеленую окраску и, вследствие гидролиза, кислую среду:
Fe 2+ + H 2 O = FeOH + + H + .
При стоянии на воздухе медленно окисляются растворенным кислородом до солей железа (III):
4FeCl 2 + O 2 + 2H 2 O = 4FeOHCl 2 .
Качественная реакция на катион Fe 2+ – взаимодействие с гексацианоферратом (III) калия (красной кровяной солью) :
FeSO 4 + K 3 = KFe↓ + K 2 SO 4
Fe 2+ + K + + 3- = KFe↓
в результате реакции образуется осадок синего цвета – гексацианоферрат (II) железа (III) - калия.
Степень окисления +3 характерна для железа.
Оксид железа (III) Fe 2 O 3 – вещество бурого цвета͵ существует в трех полиморфных модификациях.
Проявляет слабовыраженные амфотерные свойства с преобладанием базовых. Легко реагирует с кислотами:
Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O.
С растворами щелочей не реагирует, но при сплавлении образует ферриты:
Fe 2 O 3 + 2NaOH = 2NaFeO 2 + H 2 O.
Проявляет окислительные и восстановительные свойства. При нагревании восстанавливается водородом или оксидом углерода (II), проявляя окислительные свойства:
Fe 2 O 3 + H 2 = 2FeO + H 2 O,
Fe 2 O 3 + CO = 2FeO + CO 2 .
Fe 2 O 3 + 3KNO 3 + 4KOH = 2K 2 FeO 4 + 3KNO 2 + 2H 2 O.
При температуре выше 1400°С разлагается:
6Fe 2 O 3 = 4Fe 3 O 4 + O 2 .
Получается при термическом разложении гидроксида железа (III):
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
или окислением пирита:
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 .
Гидроксид железа (III) Fe(OH) 3 – кристаллическое или аморфное вещество бурого цвета. Как и оксид, проявляет слабовыраженные амфотерные свойства с преобладанием базовых. Легко реагирует с кислотами:
Fe(OH) 3 + 3HCl = FeCl 3 + 3H 2 O.
Реагирует с концентрированными растворами щелочей с образованием гексагидроксоферратов (III):
Fe(OH) 3 + 3NaOH = Na 3 ,
при сплавлении со щелочами или щелочными реагентами образует ферриты:
Fe(OH) 3 + NaOH = NaFeO 2 + 2H 2 O,
2Fe(OH) 3 + Na 2 CO 3 = 2NaFeO 2 + CO 2 + 3H 2 O.
В присутствии сильных окислителей в щелочной среде проявляет восстановительные свойства и окисляется до производных железа (VI):
2Fe(OH) 3 + 3Br 2 + 10KOH = 2K 2 FeO 4 + 6NaBr + 8H 2 O.
При нагревании разлагается:
Fe(OH) 3 = FeO(OH) + H 2 O,
2FeO(OH) = Fe 2 O 3 + H 2 O.
Получается при взаимодействии солей железа (III) с растворами щелочей:
Fe 2 (SO 4) 3 + 6NaOH = 2Fe(OH) 3 + 3Na 2 SO 4 .
Соли железа (III).
Железо (III) образует соли практически со многими анионами. Обычно соли кристаллизуются в виде бурых кристаллогидратов: Fe(NO 3) 3 ·6H 2 O, FeCl 3 ·6H 2 O, NaFe(SO 4) 2 ·12H 2 O (железные квасцы) и др.
Размещено на реф.рф
В растворе соли железа (III) значительно более устойчивы, чем соли железа (II). Растворы солей имеют желто-бурую окраску и, вследствие гидролиза, кислую среду:
Fe 3+ + H 2 O = FeOH 2+ + H + .
Соли железа (III) гидролизуют в большей степени, чем соли железа (II), по этой причине соли железа (III) и слабых кислот нельзя выделить из раствора, они мгновенно гидролизуют с образованием гидроксида железа (III):
Fe 2 (SO 4) 3 + 3Na 2 CO 3 + 3H 2 O = 2Fe(OH) 3 + 3CO 2 + 3Na 2 SO 4 .
Проявляют все свойства солей.
Обладают преимущественно восстановительными свойствами:
2FeCl 3 + 2KI = 2FeCl 2 + I 2 + 2KCl.
Качественная реакция на катион Fe 3+ – взаимодействие с гексацианоферратом (II) калия (желтой кровяной солью) :
FeCl 3 + K 4 = KFe↓ + 3KCl
Fe 3+ + K + + 4- = KFe↓
в результате реакции образуется осадок синего цвета – гексацианоферрат (III) железа (II) - калия.
Вместе с тем, ионы Fe 3+ определяют по характерному кроваво-красному окрашиванию роданида железа (III), который образуется в результате взаимодействия соли железа (III) с роданидом калия или аммония:
FeCl 3 + 3KCNS = Fe(CNS) 3 + 3KCl,
Fe 3+ + 3CNS - = Fe(CNS) 3 .
Соединения железа (III) - понятие и виды. Классификация и особенности категории "Соединения железа (III)" 2014, 2015.
Занятие №5 Тормозная система Тема №8 Механизмы управления По устройству автомобильной техники Проведения группового занятия План – конспект Преподаватель цикла ПОПОН подполковник Федотов С.А. "____"... .
Из позиции I спокойно поворачиваем ключ на 180°, в позицию II. Как только вы попадете во вторую позицию, на щитке приборов обязательно включатся какие-нибудь лампочки. Это могут быть: контрольная лампа заряда аккумуляторной батареи, лампочка аварийного давления масла,... .
В эпоху эллинизма в скульптуре усиливается тяга к пышности и гротеску. В одних произведениях показаны чрезмерные страсти, в других заметна излишняя близость к натуре. В это время начали прилежно копировать статуи прежних времён; благодаря копиям мы сегодня знаем многие... .
Начала французской готической скульптуры были заложены в Сен-Дени. Три портала западного фасада знаменитой церкви заполняли скульптурные изображения, в которых впервые проявилось стремление к строго продуманной иконографической программе, возникло желание... .Русская скульптура второй пол. XVIII века. Шубин, Козловский, Гордеев, Прокофьев, Щедрин и др.
Этьенн Морис Фальконе (1716-1791) во Франции и России (с 1766-1778 г.). "Грозящий Амур" (1757, Лувр, ГЭ) и его реплики в России. Памятник Петру I (1765-1782). Замысел и характер монумента, значение его в городском ансамбле. Роль помощницы Фальконе - Мари-Анн Колло (1748-1821) в создании... .